Polimerne nanočestice – nosači za intradermalnu/transdermalnu isporuku lijeka
Razvoj polimernih nanočestica, u svrhu kontrolisane i ciljane isporuke lijekova i prevazilaženja nedostataka tradicionalnih nosača ljekovitih supstanci, započeo je sa ciljem kontrolisanog oslobađanja ljekovite supstance, koje obezbjeđuje :
- ravnomjernu i efikasnu koncentraciju lijeka na ciljnom mjestu,
- redukuje učestalost doziranja i smanjuje mogućnost sporednih, neželjenih efekata (npr. toksični efekti nesteroidnih antinflamatornih lijekova, citostatika, antimikrobnih lijekova)
Polimerne nanočestice karakterišu dobre osobine stabilnosti i mogućnosti zaštite inkorporirane ljekovite supstance od hemijske i enzimske degradacije.
Nanoveličina ovih koloidnih nosača povećava efikasnost i preciznost medicinske dijagnostike i terapije na nivou pojedinačnih molekula ili molekulskih struktura, omogućava bolju penetraciju i efikasniju akumulaciju ljekovite supstance na ciljnim mjestima.
Polimerne nanočestice su koloidni sistemi prečnika manjeg od 1000 nm.
Međutim, mnoge studije su pokazale da je za isporuku lijekova idealan opseg veličina od 5-250 nm, jer nosači ovih veličina imaju tendenciju da posjeduju sličan niz osobina pogodnih sa fiziološkog i anatomskog aspekta isporuke ljekovite supstance.
U zavisnosti od načina sinteze, razlikuju se dvije vrste polimernih nanočestica:
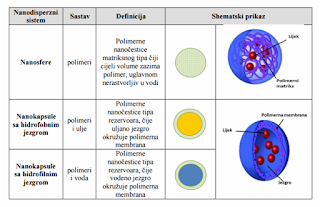
- nanosfere, koje su matriksni sistemi i čiji cijeli volumen zauzima polimer,
- nanokapsule, koje predstavljaju rezervoar sisteme, sastavljene od uljanog ili vodenog jezgra, okruženog polimernom membranom.
Podjela, definicija i šematski prikaz nanosfera i nanokapsula:

Nanočestice sposobne su da absorbuju i/ili enkapsuliraju lijek, i tako ga zaštite od hemijske ili enzimske degradacije.
U nanokapsulama, lijek je ograničen na šupljinu okruženu polimerskom ili polikristalnom membranom, dok su nanosfere matrični sistemi u kojima je lijek fizički i uniformno dispergovan.
Sada se koriste različiti stimulansi koji iniciraju raspršenje nanokapsule u datom trenutku i na definisanom mijestu.
Na Rajs univerzitetu 2002 godine patentirana je tehnologija nanoomotača za komercijalnu primjenu.
Nanoomotači su sastavni dio nanokompozita koji se sastoji iz lijeka i polimera koji je usklađen sa tumorskom metom kao dio cjelovitog sistema zajedno sa jezgrom kompozita koji se injektira u tijelo.
Nanoomotači kruže unutar tijela sve dok se potpuno ne akumuliraju u blizini tumorskih ćelija.
Kada se osvijetle infracrvenim laserom nanoomotači selektivno apsorbuju IR frekvencije, tope polimer i otpuštaju njegov lijek puneći njime specifična mjesta oboljenja.
Brojne su istraživačke grupe koje se bave istraživanjima biološke primjene zlata.
Alternativni pristup primjeni zlata otvara se istraživanjima na nanočesticama željeza i antitijela u nanobiosondama veličine od 40 nm.
Hemijski inertne sonde se injektiraju i cirkulišu u tijelu dok se antitela selektivno vežu za membranu tumorskih ćelija.
Kad se jednom tumor prekrije nanosondama posle nekoliko sati magnetno polje zagreva čestice gvožđa više od 76ºC ubijajući ćelije tumora za nekoliko sekundi.
Kad se ćelije jednom razore tijelo ih izbacuje i uklanja ćelijske ostatke i nanočestice.
Za nanobiosonde se kaže da funkcionišu slično kao pažljivo postavljen eksploziv koji se detonira daljinskim upravljačem, za razliku od hemoterapije koja ubija i nema kolateralne štete.
Prve nanočestice koje su predložene kao nosači ljekovitih supstanci bile su izrađene od želatine i umreženog albumina.
Međutim, variranje stepena čistoće polisaharida, stimulacija odgovora imunog sistema od strane proteina, kao i toksičnost sredstava za umrežavanje, bili su dovoljni razlozi da se istraživački interes ubrzo usmjeri ka upotrebi sintetskih polimera za razvoj nanočestica.
Za tu svrhu prvobitno su korišteni bio-nedegradabilni polimeri akrilamida i metil metakrilata, koji su potom zamjenjeni biodegradabilnim sintetskim polimerima, dizajniranim prvenstveno za primjenu u medicini (PLA, PGA, PLGA, PCL)
Prve rezultate ispitivanja mogućnosti primjene polimernih nanočestica za ciljanu isporuku lijekova u/kroz kožu objavili su Alvarez-Roman i saradnici.
U in vitro studijama ovi autori su dokazali ostvarivanje produženog kontakta sa kožom, te značajno poboljšanje penetracije visoko lipofilne molekule oktilmetoksicinamata (OMC) inkorporirane u biodegradabilne PCL-nanočestice.
Eksperimenti u kojima je upoređivana antimikrobna efikasnost hlorheksidina inkapsuliranog u PCL -nanokapsule u odnosu na rastvor hlorheksidin - diglukonata, dokazali su:
- odloženo oslobađanje hlorheksidina iz PCL-nanokapsula i
- poboljšanje antimikrobne aktivnosti ove supstance protiv bakterije Staphylococcus epidermidis, usljed produženog kontakta nanonosača lijeka sa uzročnikom, površinom kože i kožnim folikulama.
Mikroigle – savremeni sistemi za isporuku lijekova
Mikroigle predstavljaju čvrste ili šuplje kanale (cjevčice) čija dužina iznosi od 50- 900 µm, a spoljašnji dijameter je uglavnom manji od 300 µm.
Kako bi odgovorili različitim zahtjevima terapije, a u cilju optimizacije stepena ili mjesta isporuke lijeka, mikroigle mogu biti različitog oblika, veličine i gustine po jedinici površine potporne ili adhezivne membrane
Iako su mikroigle prvi put predstavljene još 1976. godine, tehnologija neophodna za izradu igala mikronskih dimenzija postala je dostupna tek početkom ovog vijeka, kada je započela masovna proizvodnja mikroelektičnih sredstava.
Šematski prikaz različitih mikroigala:
Prvi eksperimentalni rad o mikroiglama objavio je Hashimi sa saradnicima 1995. godine.
Mikroigle korištene u ovom radu dobijene su tehnikom graviranja iz silikonskih pločica i korištene su za intracelularnu isporuku kalceina u in vitro uslovima.
Rezultati ove in vitro studije su pokazali da mikroigle dužine 150 µm povećavaju permeabilnost kože za ispitivanu model supstancu i do četiri puta više.
Nakon što je uspješnost mikroigala u isporuci lijeka potvrđena, Kaushik je 2001. godine dokazao i potpuno bezbolnu primjenu mikroigala na ljudima.
Naime, mikroigle za transdermalnu primjenu su dizajnirane tako da, stvarajući pore mikronskih dimenzija u SC-u, penetriraju kroz epidermis do dubine od 70-200 µm, pri čemu ne dopiru do nervnih završetaka u dermisu.
Na ovaj način obezbjeđena je potpuno bezbolna primjena, što je jedna od osnovnih prednosti mikroigala u poređenju sa potkožnim iglama.
Pored bezbolne primjene, mikroigle imaju i niz drugih prednosti u poređenju sa drugim metodama za isporuku lijeka kroz kožu zbog čega se smatraju mnogo naprednijim i efikasnijim sistemima za poboljšanje trandermalnog transporta lljekovitih supstanci.
Za razliku od konvencionalnih transdermalnih flastera:
- mikroigle imaju mogućnost da potpomognu isporuku lijekova koji ne podliježu pasivnoj difuziji kroz SC
- i veličina molekule lijeka ne predstavlja ograničavajući faktor za primjenu mikroigala.
Prednosti formulacije i primjene mikroigala su i ciljana isporuka lijeka u specifična tkiva kože, potencijalno smanjenje doze kao rezultat poboljšane efikasnosti lijeka, veoma dobra podnošljivost bez dugoročnog edema ili eritema, kao i efikasnija kontrola stepena isporuke ljekovite supstance u poređenju sa isporukom lijekova kroz SC.
Tako na primjer, mikroigle pružaju mogućnost ciljane isporuke vakcina uepidermalne ćelije koje učestvuju u imunom odgovoru (Langerhansove ćelije i dermalne dendritne ćelije).
Time se obezbjeđuje primjena manjih doza u poređenju sa intramuskularnom ili subkutanom injekcijom.
Takođe, važno je napomenuti da koža ipak predstavlja barijeru za mikroigle, ali više u pogledu mehaničkih svojstava nego sa aspekta intercelularne ili hemijske strukture kože.
Iako je struktura kože veoma fleksibilna, otpor penetraciji mikroigala ipak postoji, isto kao i prema svim drugim stranim objektima mikronskih dimenzija.
Prednosti i nedostatci primjene mikroigala:
Literatura:
FORMULACIJA I KARAKTERIZACIJA RASTVORLJIVIH MIKROIGALA ZA KONTROLISANU TRANSDERMALNU ISPORUKU KETOPROFENA INKAPSULARINOG U POLIMERNE NANOČESTICE, doktorska disertacija, Sonja R. Vučen Beograd, 2013.
PRIMENA NANOMATERIJALA U MEDICINI, magistarski rad, Taina Grujić, Novi Sad, 2013.